開示会社:サイバダイン(7779)
開示書類:2025年3月期 第1四半期決算短信〔IFRS〕(連結)
開示日時:2024/08/14 15:30
<決算スコア> +0.52
<業績データ>
発表期 2024/06
種別 1Q
売上高(百万円) 1,155
前期比 +10.5% ○
営業利益(百万円) -154
前期比 +50.0% ○
経常利益(百万円) -7
前期比 -100.9% ●
純利益(百万円) 11
前期比 -96.7% ●
予想年間配当(円) -
<要約>
2025年3月期1Qの連結業績は、売上収益が前年同期比10.5%増の11億5500万円、営業損益が1億5400万円の赤字(前年同期は3億800万円の赤字)、経常損益が700万円の赤字(前年同期は7億6700万円の黒字)、純利益が同96.6%減の1100万円だった。
2024年5月にはマレーシア人的資源省大臣をはじめとするマレーシア政府関係者と、サイバニクス技術のマレーシア展開に向けたトップレベル会談を本社にて開催し、大臣より、2024年末に運用開始予定の東南アジア最大級の医療複合施設である「国立神経ロボット・サイバニクス・リハビリテーションセンター」に、HALR50セット(65台)をはじめとするサイバニクス製品の大型導入の意向が表明された。金融収益は投資有価証券評価益や為替差益などにより1億3900万円、CEJファンドに係る損益2200万円、法人所得税費用は繰延税金費用200万円などを計上した結果、親会社の所有者に帰属する純利益は減少を計上している。
日本において、医療用HALR「下肢タイプ」については、有効な治療法が確立されていない緩徐進行性の神経筋難病疾患を対象として、サイバニクス治療の普及に取り組んでいる。使用成績調査で極めて高い有効性と安全性を示す結果が得られたことを踏まえ、「他に有効な治療方法が確立していない緩徐進行性の神経・筋難病疾患の患者に対して、既承認薬も含め前例のない顕著な機能改善効果が確認された」として2022年度診療報酬改定において診療報酬点数が増点されている。脊髄疾患に関しては、ウィルス性のHTLV-1関連脊髄症(HAM)および遺伝性の痙性対麻痺の2疾患について、2022年10月に適応追加の承認を取得し、2023年10月に厚生労働省より保険適用の通知が発出された。
米国においては、個人向けの医療サービス事業のプラットフォームとして、子会社のRISEヘルスケアグループ(RHG)社はカリフォルニア州南部を中心に事業を展開している。HALRによるサイバニクス治療は現在4拠点で展開しており、2023年1月より有償サービスへ段階的に移行し、治療実績は堅調に増加している。2024年5月には、米国食品医薬品局(FDA)より、世界に先駆けて医療用HALRの小型モデルの市販承認と脳性麻痺(対象年齢は12歳以上)への適応拡大の承認を取得した。日本で承認済みのHTLV-1関連脊髄症(HAM)、遺伝性痙性対麻痺への適応疾患の拡大についても併せて承認を取得した。米国でのサイバニクス治療の実績蓄積と、医療用HALRの小型モデルの承認及び適応疾患の拡大を踏まえ、今後更なる事業拡大を推進していく。
EMEAにおいては、主要各国でのサイバニクス治療の普及が進んでおり、トルコでのHALRシリーズの大型導入に続き、2023年5月にはイタリアの医療介護サービスを専門とする大手社会協同組合Coopselios社にHALRシリーズ25台を導入後、2024年7月に追加導入(10台)が完了し、今後更に増台を計画している。ドイツにおいては、公的医療保険の当局であるG-BA(ドイツ連邦共同委員会)が、脊髄損傷に対する公的医療保険適用を前提とした臨床試験の実施を決定しており、準備が進行している。
免責文:
※東京証券取引所のTDnet(適時開示情報閲覧サービス)で開示された書類に基づく情報です。
※一部のお客様は参照文書にリンクできない場合があります。
【決算スコアについて】
企業の発表する決算や業績予想修正が、どの程度株価にインパクトを及ぼすかを統計的に算出した参考指標です。
スコア算出にあたっては、発表内容を(1)前の期の実績(2)直近の会社予想(3)市場予想(QUICKコンセンサス)--との比較で分類してパターン化。類似パターンの発表時に過去、株価がどう反応したかを分析して算出しました。算出モデルには移動平均かい離率も投入し、発表前の株価の織り込み度合いも考慮しています。
あくまで過去データに基づく統計的な値であり、個別事象の予測を目的としたものではありませんので、ご注意ください。
【QUICK AI速報】本コンテンツは、最新の言語解析技術を活用して企業の開示資料の内容を読み取って自動生成しております。データが正しく生成されていない可能性もありますので、最終的には上記リンク先の元資料をご覧ください。
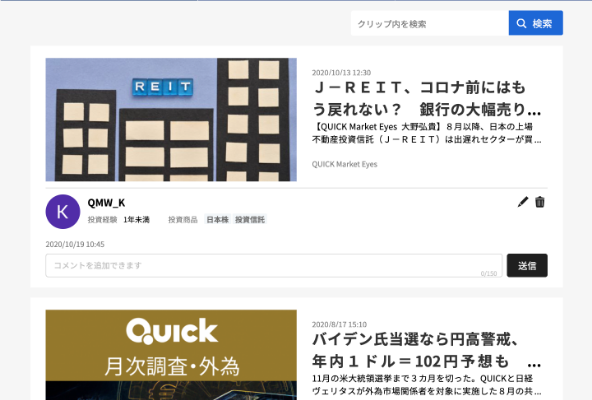
サイバダイン(7779) 1Q決算発表 決算スコア:+0.52
記事公開日 2024/8/14 15:30
最終更新日 2024/8/14 15:30
開示情報・プレスリリースの通知をメールで受け取れます!
30日間無料で体験
ニュース
サイバダイン(7779) Notice of Cybernics Product Orders in Ukraine
2024/11/18 09:40
サイバダイン(7779) ウクライナ緊急復旧・復興向けサイバニクス製品受注に関するお知らせ
2024/11/18 09:30
サイバダイン(7779) 半期報告書-第21期(2024/04/01-2025/03/31)
2024/11/14 15:35
サイバダイン(7779) 支配株主等に関する事項について
2024/6/28 17:30
サイバダイン(7779) 事業計画及び成長可能性に関する説明資料
2024/6/28 16:30
銘柄名・銘柄コード・キーワードから探す
株式ランキング
| コード/銘柄名 | 株価/前日比率 |
|---|---|
|
1
8136
サンリオ
|
4,938円
+6.28%
|
|
2
6954
ファナック
|
3,887円
-1.21%
|
|
3
4107
伊勢化
|
26,550円
+6.41%
|
|
4
5595
QPS研究
|
1,570円
+17.07%
|
|
5
7163
住信SBIネ
|
3,525円
+3.52%
|
| コード/銘柄名 | 株価/前日比率 |
|---|---|
|
1
7342
ウェルスナビ
|
1,358円
+28.35%
|
|
2
5247
BTM
|
2,254円
+21.57%
|
|
3
9252
ラストワンマイル
|
2,517円
+18.05%
|
|
4
3787
テクノマセマティ
|
660円
+17.85%
|
|
5
5950
パワーファス
|
661円
+17.82%
|
人気記事ランキング
2024/11/28 10:32
2024/11/26 15:00
2024/11/25 08:00
2024/11/26 16:00
2024/11/26 08:00