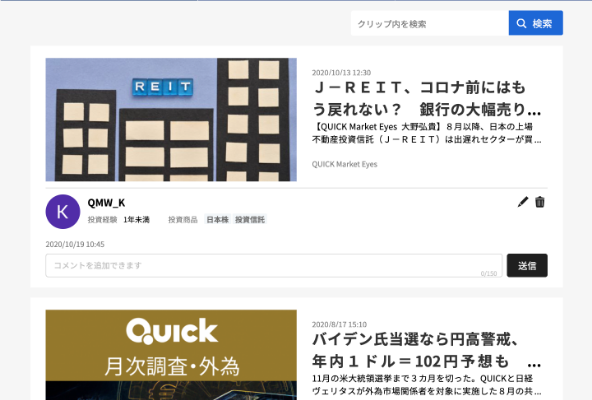
開示会社:ステラファーマ(4888)
開示書類:胸部固形悪性腫瘍を対象とした国内第I/II相臨床試験の治験開始に関するお知らせ
開示日時:2025/04/11 11:30
<引用>
当社が、国立研究開発法人国立がん研究センター中央病院(東京都中央区)、住友重機械工業株式会社(本社:東京都品川区)ならびに株式会社CICS(本社:東京都江東区)と実施する標準治療の実施が困難かつ切除不能な再発の胸部固形悪性腫瘍※1患者を対象とした[18F]FBPA-PET検査※2とBNCT(BoronNeutronCaptureTherapy:ホウ素中性子捕捉療法)を組み合わせた国内第Ⅰ/Ⅱ相臨床試験の第1例目の被験者の試験を開始しましたことをお知らせいたします。
<引用詳細>
尚、本治験につきましては、国立がん研究センター中央病院にて[18F]FBPA-PET検査から開始される予定です。本治験は、BNCTとして世界初となる胸部に発生する複数の癌を対象にした治験になります。中性子が照射される正常組織を共通化する事で複数の癌をグループ化できた事から、個別の癌に対する治験をそれぞれ実施する場合と比較して開発期間が短縮されることを期待しております。また、BNCTの施行前に[18F]FBPA-PET検査によるBNCTの適否判定を組み込む事で、将来において患者様にあわせた最適な治療を検討する事が可能になるものと期待しております。当社はBNCTという新たな治療の選択肢を一日でも早くお届けできるように、引き続き尽力してまいります。胸部固形悪性腫瘍を対象とした国内第Ⅰ/Ⅱ相臨床試験の概要目的「肺」、「心臓」、「肝臓」、「脊髄」及び「食道」が共通のリスク臓器となる標準的な放射線治療や薬物療法が実施困難かつ、切除不能な患者を対象として、BNCTの安全性及び有効性を評価する。また[18F]FBPAの安全性と[18F]FBPA-PET検査によるBNCT施行の適否判定の有用性を探索的に評価する。目標症例数30例試験デザイン第Ⅰ/Ⅱ相、単群、非盲検※3治験実施期間治験契約締結日から2028年10月31日までなお、本件による2026年3月期の業績への影響はありません。
免責文:
※東京証券取引所のTDnet(適時開示情報閲覧サービス)で開示された書類に基づく情報です。
※一部のお客様は参照文書にリンクできない場合があります。
【QUICK AI速報】本コンテンツは、最新の言語解析技術を活用して企業の開示資料の内容を読み取って自動生成しております。データが正しく生成されていない可能性もありますので、最終的には上記リンク先の元資料をご覧ください。
ステラファーマ(4888) 胸部固形悪性腫瘍を対象とした国内第I/II相臨床試験の治験開始に関するお知らせ
記事公開日 2025/4/11 11:30
最終更新日 2025/4/11 11:30
開示情報・プレスリリースの通知をメールで受け取れます!
30日間無料で体験
ニュース
ステラファーマ(4888) 再発悪性神経膠腫に関する開発方針について
2025/3/31 11:30
ステラファーマ(4888) 保有減少(9.92%→7.61%) 日興アセットマネジメント[変更報告]
2025/3/21 10:31
ステラファーマ(4888) 大阪・関西万博に出展いたします
2025/3/21 10:00
ステラファーマ(4888) 中国・海南島医療特区に向けての初回出荷のお知らせ
2025/3/13 14:00
ステラファーマ(4888) 営業外費用の計上見込みに関するお知らせ
2025/2/12 14:00
銘柄名・銘柄コード・キーワードから探す
株式ランキング
| コード/銘柄名 | 株価/前日比率 |
|---|---|
|
1
6146
ディスコ
|
26,760円
+0.86%
|
|
2
4519
中外薬
|
8,328円
+17.54%
|
|
3
9501
東電力HD
|
431.1円
+6.39%
|
|
4
4676
フジHD
|
3,140円
+3.59%
|
|
5
4894
クオリプス
|
8,050円
+12.43%
|
| コード/銘柄名 | 株価/前日比率 |
|---|---|
|
1
323A
フライヤー
|
905円
+19.86%
|
|
2
135A
VRAIN
|
2,760円
+18.65%
|
|
3
338A
Zenmu
|
9,970円
+17.7%
|
|
4
7090
リグア
|
1,000円
+17.64%
|
|
5
4519
中外薬
|
8,328円
+17.54%
|
人気記事ランキング
2025/4/15 11:09
2025/4/16 12:21
2025/4/16 17:41
2025/4/18 17:30
2025/4/18 18:39