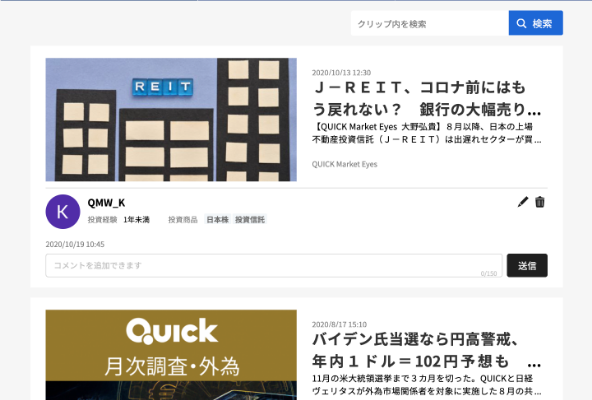
開示会社:レナサイエンス(4889)
開示書類:悪性黒色腫治療薬の第三相試験開始(患者投与開始)のお知らせ
開示日時:2025/02/18 12:00
<引用>
当社PAI-1阻害薬RS5614の悪性黒色腫*1(メラノーマ)の第Ⅲ相試験において、最初の被験者への投与が東北大学病院で実施され、治験が開始されました。本第Ⅲ相試験は、根治切除不能悪性黒色(メラノーマ)患者124例を対象に、ニボルマブ*2とのRS5614の併用の有効性及び安全性を検証する第Ⅲ相ランダム化プラセボ対象二重盲検*3医師主導治験であり、東北大学病院など国内18施設による多施設共同です。
<引用詳細>
【本試験の概要】対象抗PD-1抗体無効性進行性悪性黒色腫治験デザイン多施設共同、二重盲検、2群プラセボ対照比較試験症例数124例主要評価項目全生存期間(Overallsurvival;OS)治験実施施設(予定)東北大学病院、札幌医科大学附属病院、弘前大学医学部附属病院、自治医科大学附属さいたま医療センター、国立がん研究センター東病院、国立がん研究センター中央病院、がん研究会有明病院、新潟県立がんセンター新潟病院、静岡県立静岡がんセンター、名古屋市立大学病院、筑波大学附属病院、岐阜大学医学部附属病院、島根大学医学部附属病院、愛媛大学医学部附属病院、九州大学病院、九州がんセンター、熊本大学病院、鹿児島医療センターの18施設実施期間2025年2月~2029年7月(登録予定期間1.5年、観察予定期間3年)悪性黒色腫患者の罹患率は日本国内では10万人に1.5~2人、総患者数は約5,000人の希少疾患ですが、米国では10万人あたり21.0人、有病者数は140万人もいる皮膚がんです。免疫チェックポイント阻害薬*4の抗PD-1抗体ニボルマブの登場で、進行性悪性黒色腫(メラノーマ)の治療は大きく改善しました。さらに、抗CTLA-4抗体イピリムマブ*5が開発され、抗PD-1抗体単独での奏効率(2割程度)を高める併用療法も実施されています。しかし、自己免疫疾患の重篤副作用のため単剤投与に比べて投与中止の発現頻度は4倍と高く、さらに高額医療費の課題もあるため、副作用が無く、奏効率を上昇させる医薬品の開発が待ち望まれています。有効性及び安全性の確認を目的とする第Ⅱ相医師主導治験においてもヒトでのProof-of-Concept(有効性の証明)*6を取得し(下記)、2024年8月28日付で厚生労働省より希少疾患用医薬品*7の指定を受けました。第Ⅱ相医師主導治験の結果有効性?有効性の主要評価項目である「RS5614を8週間併用した時点での奏効率*8」は
24.1%
?疾患制御率(完全奏功CR+部分奏功PR+安定SD)は62.0%安全性?安全性解析対象例34例のうち、治療開始8週時点までに生じた重篤な有害事象は9例11件で、治験薬との因果関係の可能性があるのは肝機能障害2件(5.9%)当社が開発するPAI-1阻害薬RS5614は低分子医薬品であり、安全性は極めて高く、自宅でも服用可能な利便性の高い内服薬です。この第Ⅲ相試験は、RS5614の悪性黒色種に対する薬事承認を得るための検証試験になります。【業績への影響】本件による2025年3月期業績への影響は現時点では特にありません。
免責文:
※東京証券取引所のTDnet(適時開示情報閲覧サービス)で開示された書類に基づく情報です。
※一部のお客様は参照文書にリンクできない場合があります。
【QUICK AI速報】本コンテンツは、最新の言語解析技術を活用して企業の開示資料の内容を読み取って自動生成しております。データが正しく生成されていない可能性もありますので、最終的には上記リンク先の元資料をご覧ください。
レナサイエンス(4889) 悪性黒色腫治療薬の第三相試験開始(患者投与開始)のお知らせ
記事公開日 2025/2/18 12:00
最終更新日 2025/2/18 12:00
開示情報・プレスリリースの通知をメールで受け取れます!
30日間無料で体験
ニュース
レナサイエンス(4889) 糖尿病患者のインスリン投与量を予測する人工知能(AI)の臨床性能試験の最終結果のお知らせ
2025/3/6 15:30
レナサイエンス(4889) 3Q決算発表 決算スコア:-2.02
2025/2/13 15:30
レナサイエンス(4889) チェスト株式会社による呼吸機能検査診断AIのオプション権行使に伴う一時金受領のお知らせ
2025/2/12 15:30
レナサイエンス(4889) 保有減少(6.83%→5.76%) DCIパートナーズ[変更報告]
2025/2/3 15:56
レナサイエンス(4889) よくあるご質問と回答
2025/2/3 09:15
銘柄名・銘柄コード・キーワードから探す
株式ランキング
| コード/銘柄名 | 株価/前日比率 |
|---|---|
|
1
6146
ディスコ
|
26,760円
+0.86%
|
|
2
4519
中外薬
|
8,328円
+17.54%
|
|
3
9501
東電力HD
|
431.1円
+6.39%
|
|
4
4676
フジHD
|
3,140円
+3.59%
|
|
5
4894
クオリプス
|
8,050円
+12.43%
|
| コード/銘柄名 | 株価/前日比率 |
|---|---|
|
1
323A
フライヤー
|
905円
+19.86%
|
|
2
135A
VRAIN
|
2,760円
+18.65%
|
|
3
338A
Zenmu
|
9,970円
+17.7%
|
|
4
7090
リグア
|
1,000円
+17.64%
|
|
5
4519
中外薬
|
8,328円
+17.54%
|
人気記事ランキング
2025/4/15 11:09
2025/4/16 12:21
2025/4/16 17:41
2025/4/18 17:30
2025/4/18 18:39